
Progrès fantastiques et limites de la biologie par Michel Delseny, LGDP, (Argeles 14.02.2019)
Les progrès fantastiques de la biologie et leurs limites
- L’essor de la biologie moléculaire et de la génomique
- Les conséquences de l’essor de la génomique
- Les limites de la biologie moléculaire
- La manipulation du génome
- Autres développements :
• Greffes et prothèses
• Cellules souches
• Le système nerveux
• Le système immunitaire
- Un homme augmenté ?
La molécule d’ADN
James Watson et Francis Crick, Prix Nobel de Médecine 1962 avec Maurice Wilkins
- Sa structure est découverte en 1953 par James Watson et Francis Crick, grâce aux travaux de Maurice Wilkins et Rosalind Franklin
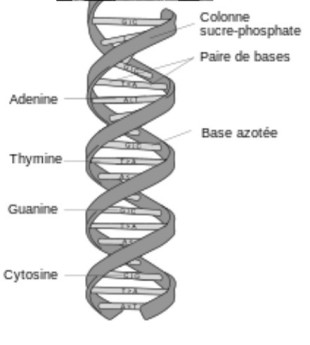
- Une molécule complexe: cinq atomes (H, C, O, N ,P) assemblés en 4 bases azotées, un sucre et un phosphate, eux mémes assemblés en un polymère constitué de deux brins complémentaires formant une double hélice.
- 3,4 dix millionièmes de mm d’épaisseur et plusieurs dizaines de cm de longueur ( environ 2 m par noyau de cellule humaine et 500X la distance terre soleil pour la longueur de tout l’ADN d’un homme !)
- Plusieurs dizaines de millions d’un module élémentaire: la paire de nucléotides (phosphate, sucre, base). 3,2 milliards pour le génome humain, distribués sur 23 paires de chromosomes
- Quatre bases possibles: Adénine (A), Guanine (G), Thymine (T), Cytosine (C).
- A et T sont complémentaires, de même G et C et forment les paires de bases.
- La séquence est l’ordre des bases sur un brin.
- Trois bases successives déterminent un acide aminé selon le code génétique.
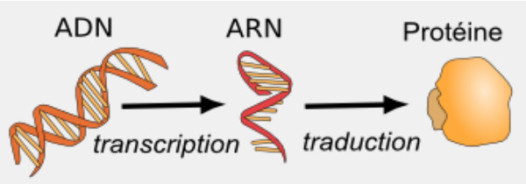
- Chaque gène est recopié en ARN et ensuite traduit en protéine.
- L’ARN n’a qu’un brin, il est complémentaire de l’un des brins d’ADN.
Le dogme fondamental de la biologie moléculaire
Une avancée cruciale: le séquençage de l’ADN (1975)
Frederick Sanger (1918-2013): un double Prix Nobel de chimie

- Séquençage des protéines (insuline) : 1958
- Séquençage de l’ADN (phage Φ X 174) : 1980
- Prix Nobel 1980 partagé avec Walter Gilbert et Paul Berg
Une série d’innovations stratégiques

- Les ESTs (Expressed Sequence Tags) ou étiquettes ADNc (1989)
- Le séquençage au hasard de fragments d’ADN à leurs deux extrémités, issus de librairies de fragments de tailles différentes (1996)
- Séquençage d’ADN à partir de populations ou d’écosystèmes, plutôt que d’individus (2004)
- Synthèse d’un chromosome artificiel (2004)
(photo : Craig Venter)
La génomique
Une nouvelle discipline qui révolutionne la biologie: le séquençage, le décryptage des génomes et l'étude de leur fonctionnement.
- 1975: mise au point des techniques de séquençage
- 1980: séquence du gène de b globine humaine
- 1990: lancement du HGP (Human Genome Programme) et premières EST humaines
- 1996: séquençage du génome de la levure (14 Mbp)
- 1999: séquençage du premier chromosome humain, le chromosome 22
- 2000: séquençage du génome de la Drosophile et du premier génome de plante (Arabidopsis thaliana) (120 Mbp)
- 2001: premiers brouillons du génome humain (2900 Mbp)
- 2004: complétion du génome humain
- Des outils pour étudier la structure et l’expression des gènes à l’échelle du génome: bioinformatique, puces à ADN...
- 2010: séquençage du génome de l’homme de Neandertal
- 2018: plusieurs dizaines de milliers de génomes humain disponibles
Sequençage du génome humain

Un quadruple problème
- Assembler et reconstituer la séquence de chaque chromosome.
- Trouver et définir les gènes le long de la séquence.
- Attribuer une fonction à chaque gène.
- Comprendre comment le fonctionnement de chaque gène est intégré pour contrôler le développement et les réponses de l’individu
Quelques surprises, qui n’en étaient pas vraiment !
- Des gènes en morceaux qui peuvent coder plusieurs protéines
- De très nombreux gènes sont conservés chez les différents êtres vivants
- Moins de gènes que prévu (27 000), alors qu’on en attendait près de 100 000
- De nombreux gènes dupliqués
- Moins de 5% du génome est représenté par des gènes: à quoi sert le reste ? Régulation, poubelle, réservoir ou résidu évolutif ?
Comment identifier la fonction d’un gène?
- Logiciels de prédiction (bio-informatique).
- Logiciels de comparaison avec d'autres gènes déjà identifiés: génomique comparative.
- Obtention de mutants, cartographie génétique, isolement du gène et complémentation fonctionnelle du mutant.
- Caractérisation de son expression (temps, lieu et inducteurs), co-expression avec des gènes connus.
- Fabrication d'une protéine recombinante et analyse biochimique de sa fonction.
Une accélération phénoménale du séquençage des génomes
- Des technologies nouvelles plus efficaces, couplées à des robots.
- Un abaissement considérable du coût du séquençage: réduction par un facteur >10 000 X.
- Un génome humain est séquençable en un peu plus d’une semaine pour ~1000 €!
- Des progrès considérables dans l’informatique pour le stockage et l’analyse des données
- Mais une qualité et une précision moins bonne
Qu’avons-nous appris ?
- Un répertoire des gènes
- Quand et où les gènes s’expriment
- La fonction probable de 60-70% des gènes
- Le mode de fonctionnement et les principes généraux de la régulation des gènes
- Une très grande diversité génétique entre individus, qui permet de repérer dans une population les mutations associées à un caractère défini (GWAS)
- L’identification de gènes corrélés à des maladies (ex mucoviscidose, chorée de huntington, prédisposition à certains cancers (BCRA et cancer du sein), inflamation chronique...)
- Hétérogénéïté génétique des tumeurs
- Des outils pour comprendre le fonctionnement cellulaire et la physiologie
Retombées de la génomique
- Médecine prédictive: possibilité de prédire la prédisposition à une maladie : ça ne marche qu’avec des maladies simples, dans lesquelles quelques gènes sont impliqués.
- Médecine personnalisée, cas des cancers : carte génétique des tumeurs et étude de leurs réponses aux différents traitements .
- Possibilité d’affiner les diagnostics et d’adapter les traitements
- Découverte des microbiotes et établissement de corrélations entre microbiote et prédisposition à des maladies (diabète, obésité, troubles neurologiques...) ou réponses aux traitements
Les limites de la génomique
- On est loin de tout connaitre : de nombreux gènes ont une fonction inconnue
- La fonction de >90 % du génome est encore mal connue, voire inconnue
- Les mécanismes de régulation de l’expression des gènes sont plus complexes que prévus
- La génétique n’explique pas tout : de nombreux caractères ou maladies dépendent d’une multitude de gènes (hypertension, diabète, intelligence...) et de l’environnement
- Il reste à comprendre les interactions entre le génome et l’environnement, avec les autres êtres vivants, avec le microbiote
- De nombreux caractères ou modifications de caractères au cours de la vie ont une origine épigénétique, encore mal élucidée (développement, apprentissage...)
- Des questions éthiques: confidentialité, accès et exploitation des données individuelles
La thérapie génique
- Possibilité de réintroduire un gène fonctionnel dans des tissus ou un organisme
- Suppose d’avoir identifié le gène responsable
- Suppose de disposer d’un vecteur pour introduire le gène (le vecteur est généralement un virus modifié « désarmé » comme un adénovirus)
- Suppose de savoir contrôler l’expression du gène introduit
- Transformation de cellules in vitro que l’on réintroduit ou injection directe du virus vecteur
- Efficace (thalassémie, leucémie...), mais problèmes: apparition de cancers secondaires, durée du traitement...
- Avis nécessaire des comités d’éthique et consentement des patients
Une nouvelle révolution en génie génétique: l’édition génomique CRISPR-Cas9

- Découverte par Jennifer Doudna et Emmanuelle Charpentier, en 2012, d’un nouveau mécanisme d’immunité des bactéries vis-à-vis des virus chez Streptococcus pyogenes: CRISPR-Cas9.
- CRISPR9: Clustered Regularly Insterspersed Padindromic Repeats, Cas 9 endonucléase associée à CRISPR
- Le système CRISPR-Cas9 permet de réparer ou de remplacer précisément un gène dans une cellule.
- Il n’y a pas besoin de vecteur, il n’y a pas d’ADN étranger, la modification est ciblée
- Déjà des applications en médecine et en amélioration des plantes
- Cette technologie permet, en principe de corriger un gène et de guérir une mutation, ou de rajouter un gène
- Des questions éthiques quant aux applications pratiques
Un scientifique chinois a fait naître les premiers bébés CRISPR
-

- Jian-Kui He (Shenzhen) annonce fin novembre 2018 la naissance de Lulu et Nana, deux bébés génétiquement modifiés !
- Une troisième naissance est prévue
- Le gène CCR5 a eté modifié pour conférer une résistance au virus du SIDA
- Tollé international et chinois, car expérience aléatoire et non respect des règles éthiques et déontologiques
- Incertitudes scientifiques: efficacité ? Effets secondaires ?Bénéfice relatif par rapport aux
- alternatives ? Modification partielle (embryons chimériques)...
- Chercheur assigné à résidence et poursuivi par la justice chinoise
Autres progrès : au delà des génomes
- Greffes et prothèses
- Découverte des cellules souches
- Induction de cellules souches pluripotentes et possibilité d’orienter leur différenciation
- Développement d’organoïdes (muscle, foie, peau)
- Autogreffes
- Compréhension du fonctionnement du cerveau et des neurones : imagerie, biologie moléculaire, identification des neurotransmetteurs, des récepteurs...
- Travaux essentiellement sur les neurones, mais rôle des cellules gliales presque complètement ignoré
- Progrès en immunologie et immunothérapie des tumeurs
- Développement de l’intelligence artificielle et de la robotique: connexion homme-machine
Vers un homme augmenté ?
- Beaucoup d’outils pour nous faciliter la vie, la santé et les soins
- Mais de nombreux problèmes non résolus
- Grande ignorance de nombreux processus cellulaires , développementaux
- Grande ignorance des interactions génome et environnement
- Fiabilité des prédictions souvent issues de l’intelligence artificielle
- Qualité des bases de données
- Coût et suivi des prothèses
- Coût financier et social des innovations
- Problèmes éthiques : pas d’intervention sur la lignée germinale ni sur l’embryon, tentation eugéniste, quels bénéficiaires, quelles responsabilités en cas de dysfonctionnement...?
Merci à Michel Delseny pour cette conférence et d'avoir permis de mettre en note ici son diaporama









